Alle
Lebewesen weisen die gleichen chemischen Grundbausteine auf und haben den
gleichen genetischen Code („Universalität des genetischen Codes“).
Viele
Stoffwechselprozesse wie Glycolyse,
Citronensäurezyklus, Energieübertragung durch
ATP
und die Proteinbiosynthese
laufen bei der Mehrzahl der Pflanzen und Tiere
gleich ab und belegen eine gemeinsame Abstammung.
Proteine
sind dabei die wichtigsten Bausteine aller Lebewesen. Sie setzten sich aus
verschiedenen Aminosäuren zusammen, die in einer bestimmten, genetisch
bedingten Reihenfolge (Aminosäuresequenz) miteinander verbunden sind. Aus der
Aminosäuresequenz ergibt sich die
Primärstruktur
des Eiweißes.
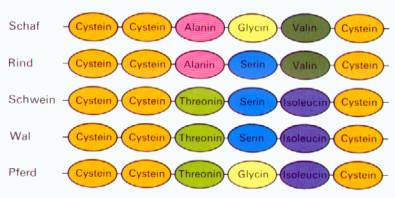
Das
Hormon Insulin ist ein Peptid,
das aus 51 Aminosäuren besteht. Bei einer vergleichenden Sequenzanalyse dieses
Hormons stößt man auf artspezifische Unterschiede in der Reihenfolge der
Aminosäuren, obwohl die Wirkungsweise bei allen Wirbeltierarten
gleich ist. Jede Abweichung in der Aminosäuresequenz bedeutet eine Mutation,
die im Laufe der Evolution stattgefunden hat. Je stärker die Abweichungen in
der Aminosäuresequenz sind, desto mehr Mutationen haben stattgefunden uns desto
weniger nah können die Tierarten miteinander verwandt sein. Der in der
Abbildung (siehe unten) dargestellte Abschnitt der Insulinmoleküle
verschiedener Tiere weist zwischen Schaf und Rind nur an einer Position,
zwischen Schaf und Wal aber an drei Positionen Abweichungen in der Aminosäuresequenz
auf.
 |
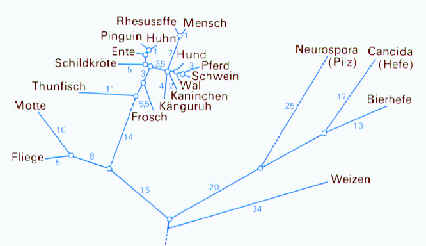
Das im Tier- und Pflanzenreich verbreitete Atmungsferment Cytochrom besteht aus einer Polypeptidkette von 104 Aminosäuren. Im Molekül können an etwa 70 Positionen Aminosäuren ausgetauscht werden, ohne dass Cytochrom C seine Funktionstüchtigkeit verliert. Die Zahl der Abweichungen in der Aminosäuresequenz ist in der Abbildung (siehe unten) in einem „Cytochromstammbaum“ dargestellt. Im Verwandtschaftskreis der Vögel haben kaum Mutationsschritte bezüglich dieses Proteins stattgefunden. Andererseits besteht ein deutlicher Unterschied z.B. gegenüber den Aminosäuresequenzen bei Schildkröten oder Säugetieren. Mensch und Rhesusaffe unterscheiden sich bezüglich des Cytochroms C nur in einer einzigen Aminosäure.

Wirbeltiere reagieren auf den Kontakt mit artfremdem Eiweiß in ihrem Blutgefäßsystem durch die Bildung spezifischer Antikörper. Diese wirken in der Regel nur gegen ein bestimmtes Fremdeiweiß (Antigen) und reagieren mit diesem unter Bildung von Antigen-Antikörper-Komplexen. Durch diese Abwehrreaktion wird artfremdes Eiweiß ausgefällt und damit unschädlich gemacht.
Antigen-Antikörper-Reaktionen können ebenfalls zur Klärung von Verwandtschaftsbeziehungen von Tierarten beitragen.
Impft
man beispielsweise ein Kaninchen mit Blutserum vom Menschen, so bilden sich im
Blut des Kaninchens entsprechende Antikörper gegen die menschlichen
Serumproteine aus. Gewinnt man nach etwa 2 Wochen von einem derart
vorbehandelten Kaninchen das Blutserum und bringt dieses mit menschlichem
Blutserum zusammen, so kann man eine deutliche Ausflockung von Serumproteinen
beobachten. Dies geht auf die Ausfällung von spezifischen Antigen-Antikörper-Komplexen
zurück.
Gibt
man zum Blutserum des mit menschlichem Blut vorbehandelten Kaninchen
Serum
von anderen Säugetieren, so ist der Ausflockungsgrad um so geringer, je unähnlicher
deren Serumproteine denjenigen des Menschenserums sind. Da die Antikörper im
Serum des Kaninchens spezifisch gegen menschliche Serumproteine gebildet worden
sind, mit denen sie – wie ein Schlüssel zu einem Schloss – zusammenpassen,
fällt die Antigen-Antikörper-Reaktion mit den Eiweißstoffen andersartiger
Blutseren um so unspezifischer aus, je stärker sich die Raumstrukturen dieser
Proteine von denen menschlichen Serumproteinen unterscheiden.
Ein
quantitativer Vergleich des Ausflockungsgrades verschiedener Tierseren
 |
Serologische
Untersuchungen haben z.B. ergeben, dass Hasen trotz ihres nagetierähnlichen
Gebisses näher mit den Huftieren als mit den Nagetieren verwandt zu sein
scheinen. Das ähnliche Gebiss von Hasen und Nagetieren wäre demnach offensichtlich
durch Konvergenz
entstanden.
Bisher
gibt es keinerlei Fossilfunde, die auf eine gemeinsame Stammesgeschichte von
Hasen und Nagetieren hinweisen.
Serologische
Untersuchungen allein reichen aber nicht aus, um den Verwandtschaftsgrad zweier
Tierarten endgültig festzulegen. Sie können nur im Zusammenhang mit allen übrigen
Indizien über Verwandtschaftsbeziehungen gesehen werden.